

日前,复诺健生物收到FDA治疗药品办公室(Office of Therapeutic Products)的正式书面回函,其原创开发的溶瘤病毒产品I类创新药VG161被授予FDA快速通道资格(Fast Track Designation, FTD),用于治疗经标准治疗失败的晚期肝细胞癌(Advanced Unresectable Hepatocellular Carcinoma)。
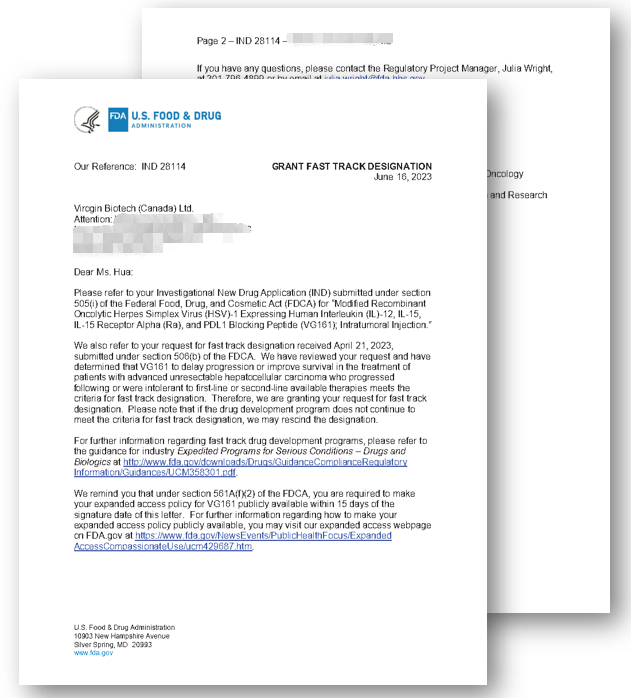
FDA回函中表示:(对于)经过目前可用的一线或二线治疗后进展或不耐受的不可手术切除的晚期肝细胞癌患者,(VG161)能够延缓肿瘤进展或改善生存期,达到FDA审评标准。
此次FDA给予VG161快速通道资格的决定,充分表明其认可VG161作为溶瘤病毒疗法的临床药效以及解决未满足的临床需求的巨大潜力。VG161有望成为晚期肝细胞癌患者的更好治疗选择。
作为复诺健Synerlytic™技术平台的首个产品,VG161已成功完成了I期临床试验,正在中美两地进行多个临床II期试验(单药与联合用药),鉴于产品展现出的优越安全性和令人振奋的初步有效性结果,于2023年2月获得FDA孤儿药资格认定。
此次取得FTD后,复诺健将在后续的药物研发与审评过程中,获得更多与FDA沟通交流的机会;还可以在提交上市申请(NDA/BLA)时,向FDA滚动递交(Rolling Submission)新药研究资料。以上政策都有助于加快VG161后续研发和批准上市。
随着全球临床策略的持续稳步推进,复诺健卓越的创新研发能力和溶瘤病毒产品的治疗潜力,已经在强大的临床转化和临床研发能力的支持下逐步展现。复诺健将进一步秉持“以癌症病人的需求为导向”的理念,全力在溶瘤病毒和mRNA癌症治疗方案领域砥砺前行,开发并提供新一代抗肿瘤免疫治疗方案。
关于VG161
VG161是新型抗肿瘤免疫增强型I型单纯疱疹溶瘤病毒,它同时携带IL12、IL15/15RA(IL15和IL15受体α亚基)和PD-L1阻断肽(PDL1B)的基因,是全球最早实现一个病毒表达4个具有协同性抗肿瘤免疫刺激作用的基因的溶瘤病毒。
通过瘤内注射进入肿瘤组织,病毒在肿瘤细胞内复制和溶解肿瘤细胞的同时,携带的4个免疫刺激因子均被有效表达,实现了溶瘤活性与免疫刺激的协同。同时,病毒所表达的4个免疫刺激因子之间也发生进一步的协同增效,从而把抗病毒免疫反应转化为特异性的抗肿瘤免疫反应。
VG161在多个肿瘤模型,特别是临床未满足需求很高的肝癌、软组织肉瘤和胰腺癌模型上显示了显著的抗肿瘤药效。各项临床前安评实验和生物分布实验显示VG161具有很好的安全性和肿瘤特异性分布。
来源:复诺健生物